丙酮酸羧化酶(PC)(EC 6.4.1.1)是一种含生物素的酶,可通过两步反应催化丙酮酸羧化。我们研究发现突变R548K,Q552N和Q552A导致催化丙酮酸羧化,草酰乙酸的生物素依赖性脱羧以及丙酮酸和水之间的质子交换的能力丧失。
这些突变体保留了催化生物素羧化酶结构域活性位点发生的反应的能力,即碳酸氢盐依赖性ATP切割和氨基甲酰磷酸酯的ADP磷酸化,草酸对Arg548和Gln552突变体催化生物素羧化酶域的作用与野生型酶催化反应的影响相似。
一、构建野生型PC和突变体
我们在对应于CT结构域的1.0 kb BamH I-XhoI PC基因片段上进行诱变,进行诱变反应,制备T882A突变体,通过DNA测序验证了突变。
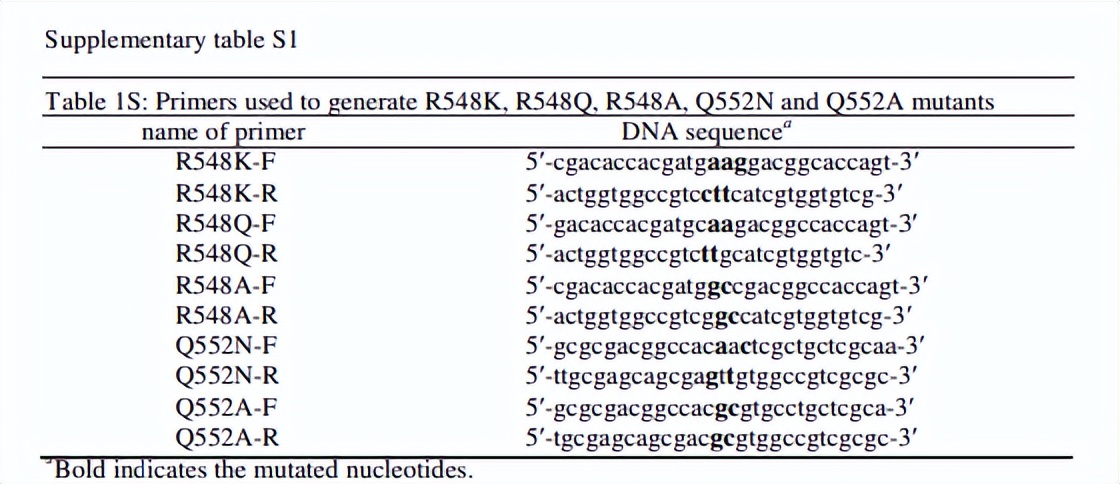
用于生成R548K,R548Q,R548A,Q552N和Q552A突变体的引物如下表所示,然后用诱变片段替换表达克隆中野生型RePC基因的等效片段。
BL21(DE3)大肠杆菌含有编码大肠杆菌BirA基因的pCY216质粒,实验中使用野生型RePC或突变体转化大肠杆菌BL21(DE3),将其在30升LL肉汤中生长,该培养基中补充了8.6 g/L阿拉伯糖、25 mg/L生物素、10 mg/L氨苄青霉素和200 mg/L氯霉素。
将培养物在37°C下生长,直到OD600达到1.0-1.2,在10°C下加入1.16mM IPTG诱导RePC表达,诱导时间为约36小时,在4°C下以000,4rpm离心15分钟,收获细胞,为了破坏收获的细胞,使用1mg/mL溶菌酶孵育,然后用珠状打浆器™(Biospec)进行裂解。
按照之前的方法,通过硫酸鱼精蛋白沉淀除去裂解物中的核酸,将裂解物中的蛋白质用36%(w/v)饱和硫酸铵沉淀,并重悬于上样缓冲液(50 mM NaH2PO4,300 mM NaCl,10 mM咪唑,pH 7.4),加载到20 ml HisPur™钴树脂色谱柱上。
使用50 mM NaH2PO4,300 mM氯化钠,150 mM咪唑,pH 7.4从色谱柱中洗脱PC,纯化的PC储存在-80°C的储存缓冲液中,该缓冲液含有30%甘油,0.1M Tris-Cl,pH 7.8和1mM DTE。
将5μl等分试样的酶与85μl0.2M磷酸钾缓冲液(pH 7.2)混合,加入10μl 2%(w/v)胰凝乳蛋白酶(Sigma)到混合溶液中,把溶液置于37°C下孵育24小时。
沉降速度分析通常使用实验室的XL-A超速离心机进行,通过吸光度光学系统对蛋白质进行可视化,分析中,波长设定为278-280 nm,使用双扇区细胞,每0.003厘米采集一次数据。
数据采集以300次吸光度扫描的形式进行,标称时间增量为1分钟,在30°C下以40,000 rpm的速度进行离心。
在所有情况下,酶样品的制备条件为0.1 M Tris-HCl(pH 7.8),20 mM NaHCO3,10 mM丙酮酸,5 mM氯化镁,0.1 mM乙酰辅酶A和1 mM DTE,酶的浓度为0.2毫克/毫升,计算机捕获的数据将由SEDFIT进行分析,酶的部分比体积是使用SEDNTERP根据氨基酸组成计算得出的,Tris缓冲液的密度被假定为1.005 g/ml,假设该密度适用于酶溶液。
二、丙酮酸羧化测定
使用偶联分光光度测定法,进行一式三份的丙酮酸羧化活性测定,在该反应中,产生的草酰乙酸在苹果酸脱氢酶的催化下转化为苹果酸,反应在30°C下进行,在一个含有10 ml反应混合物的体系中进行。
该反应混合物包含1.0 M Tris-HCl pH 1.7、8 mM丙酮酸、10.2 mM ATP、5.0 mM乙酰辅酶A、25.0 mM NADH、3 mM NaHCO3和5单位的苹果酸脱氢酶,测定开始时,加入RePC(50-200μg),
通过测量反应速度并将其除以测定中所使用的PC的生物素浓度,计算表观kcat值。
生物素依赖性草酰乙酸脱羧的测定按照先前的描述进行,对于野生型RePC和每个突变体,制备三种溶液如下:(1)在400μl 0.1M Tris-HCl,pH 7.8中混合1mg酶和2mg亲和素;(2)在400μl 0.1M Tris-HCl,pH 7.8中混合1mg酶;(3)在400μl 0.1M Tris-HCl,pH 7.8中混合2mg亲和素。将这些溶液在30°C下孵育1.5小时。
测定溶液(1)的等分试样的丙酮酸羧化活性,以验证其是否被亲和素完全抑制,在20μM、25μM和100μM草酰乙酸下,测定每种溶液的200μl等分试样的草酰乙酸脱羧活性,其他反应组分包括100 mM Tris-HCl pH 7.8,0.25 mM乙酰辅酶A,0.2 mM NADH和4单位乳酸脱氢酶。

此外,在存在2.200mM草酸的条件下,还测定溶液的等分试样在5μM草酰乙酸下的草酰乙酸脱羧活性,通过将测得的反应速度除以测定中所使用的RePC的生物素浓度,计算表观kcat值。
ATP切割活性的测定是通过测量葡萄糖-6-磷酸脱氢酶、磷酸葡萄糖变位酶和磷酸化酶A偶联酶系统释放的无机磷酸盐(Pi)的量来确定的,具体步骤如所描述,测定在30°C下进行,起始时加入50μg的RePC。

反应体系包含0.1 M Tris-HCl,pH 7.8,2.5 mM MgATP,2.5 mM MgCl2,0.33 mM NADP,0.25 mM 乙酰辅酶A,5μM α-葡萄糖-1-磷酸,1mg/ml糖原,2单位磷酸化酶A,3单位磷酸葡萄糖变位酶和3单位葡萄糖-6-磷酸脱氢酶,通过测量340nm处吸光度的增加来确定NADPH的产生。
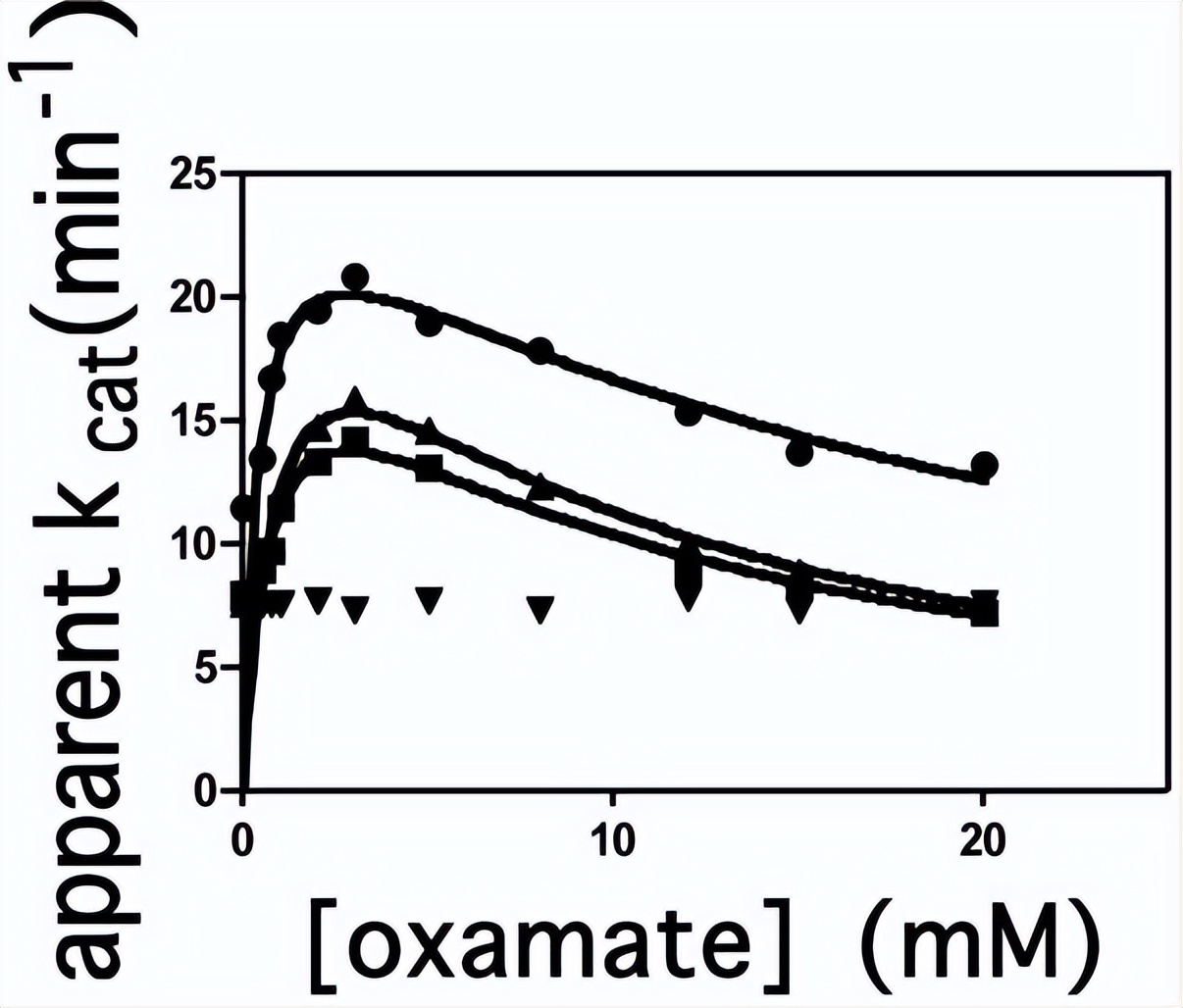
为了确定草酸酯对ATP切割活性的影响,测定了在不同浓度草酸(0-20mM)下Pi释放的初始速率,通过将测得的反应速度除以测定中所使用的RePC的生物素浓度,计算表观kcat值。

使用氨基甲酰磷酸酯进行分光光度法测定氨基甲酰磷酸酯催化的ADP磷酸化反应的ATP合成初始速率,该反应使用己糖激酶和葡萄糖-6-磷酸脱氢酶的偶联酶系统进行,NADPH的产生通过在30°C下测量340nm处吸光度的增加来确定。
反应体系包含0.1 M Tris-HCl,pH 7.8,20 mM氨基甲酰磷酸酯,3.0 mM MgADP,5 mM MgCl2,0.25 mM乙酰辅酶A,0.24 mM NADP,0.20 mM葡萄糖,3单位葡萄糖-6-磷酸脱氢酶和1单位己糖激酶。
丙酮酸通过将草酰乙酸溶解在D中制备2O至终浓度为10mM,将溶液温育30分钟,用在D中制备的6M NaOHpH调节至0.12O,把溶液密封在小瓶中并在30°C下孵育长达36小时,直到使用苹果酸脱氢酶的分光光度测定表明溶液中没有残留的草酰乙酸。
将剩余的溶液冻干,并将所得粉末储存在4°C,当溶液含有[3-2H3]使用丙酮酸,用乳酸脱氢酶分光光度法测定丙酮酸的浓度。
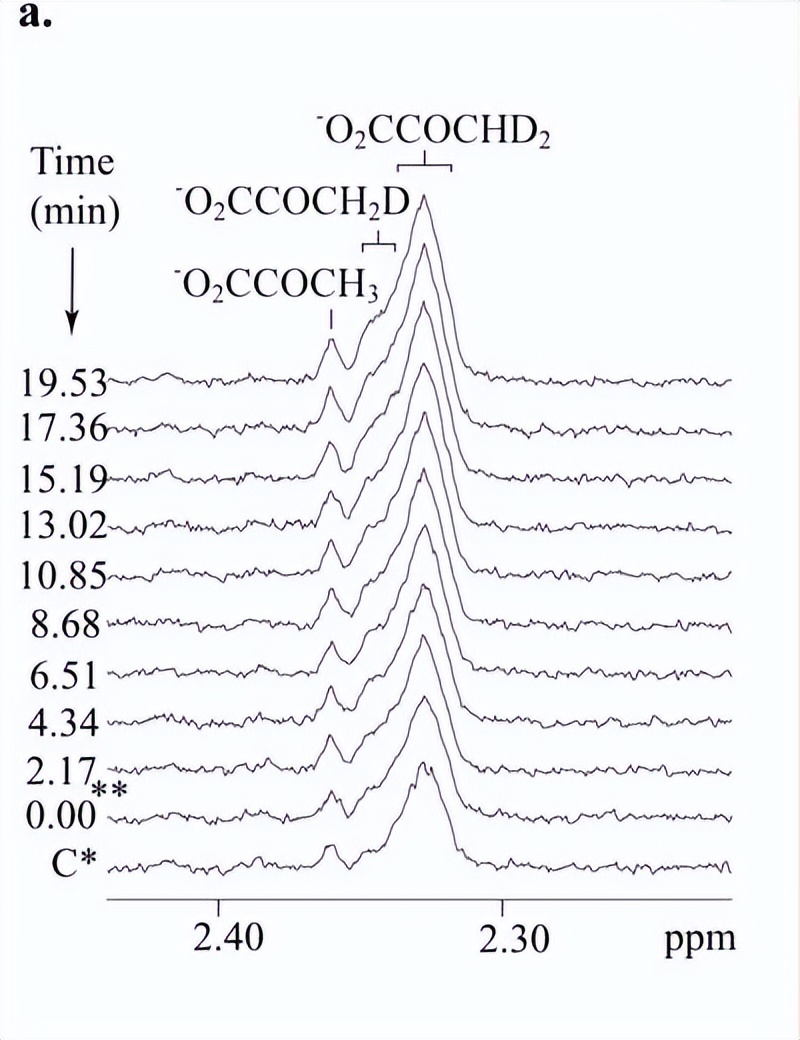
1H NMR 实验是在 AV500 NMR 波谱仪上进行的,由野生型和突变型RePC催化的质子交换的初始速率以两种不同的方式确定,使用[3-2H3]丙酮酸95%H2O作为基底或[3-1H3]丙酮酸90%D2O为基底。
当 [3-2H3]以丙酮酸为底物,新出现的峰在1对应于各种(单、二和三)质子化丙酮酸物种形成的H NMR波谱在每个时间点进行积分,在30°C下以95%H监测反应2O 和 5% D2O 含有 20 mM 碳酸氢铵和 10 mM [3-2H3]丙酮酸总体积为1ml。
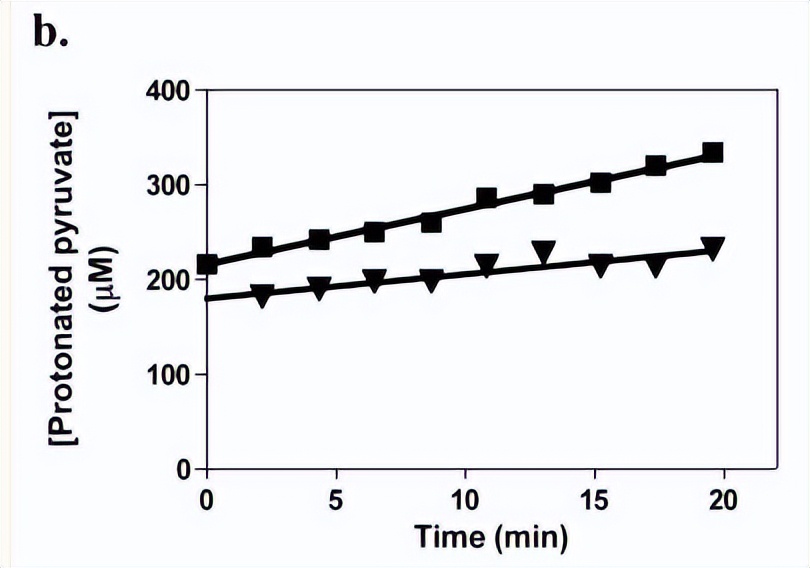
通过加入10μg野生型RePC或250μg突变型RePC酶引发反应,在反应混合物不含酶的情况下,还进行了对照,反应的时间过程中没有可测量的质子交换速率,将反应混合物(减酶)在30°C下与30单位苹果酸脱氢酶和5.0mM NADH预温育2分钟,以除去合成中残留的痕量草酰乙酸[3-2H3]丙酮酸,随后通过加入250μg野生型RePC引发反应。
通过线性回归分析数据以确定初始质子交换率,在校正任何非酶质子交换后,将其除以酶生物素浓度以获得表观的一阶速率常数。
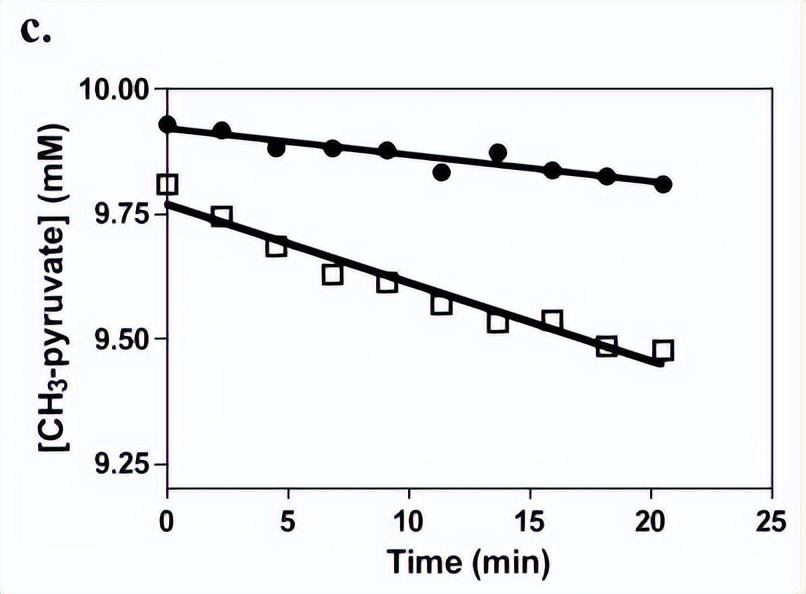
三、数据分析
非线性最小二乘回归拟合分析草酸酯对ATP切割活性的底物抑制数据,其中A是草酸的浓度,Kcat一个是激活常数和 Ka是抑制常数,这表观 Kcat是草酸和k每种浓度下的表观一级速率常数a是计算出的最大表观一阶速率常数。
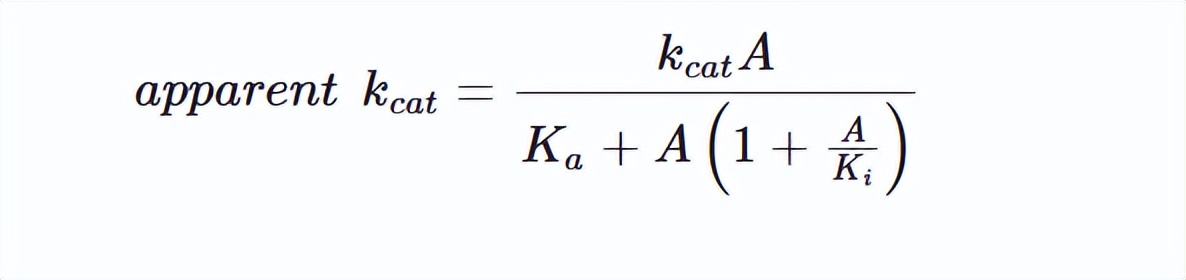
在饱和底物和乙酰辅酶A水平下,测定了野生型和突变型RePC的丙酮酸羧化活性,野生型RePC的kcat值被确定为834 ± 39分钟-1,而R548K突变型为17 ± 3分钟-1(仅为野生型的2%),而其他四种突变体中没有检测到任何活性。
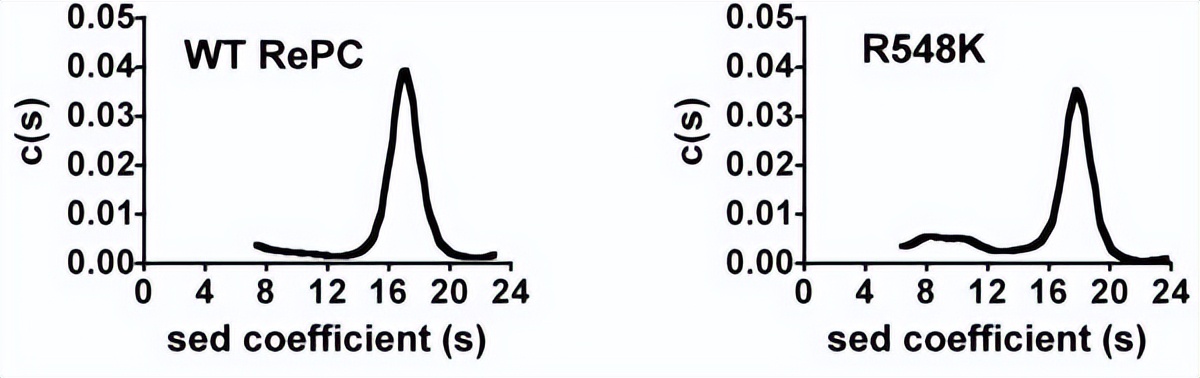
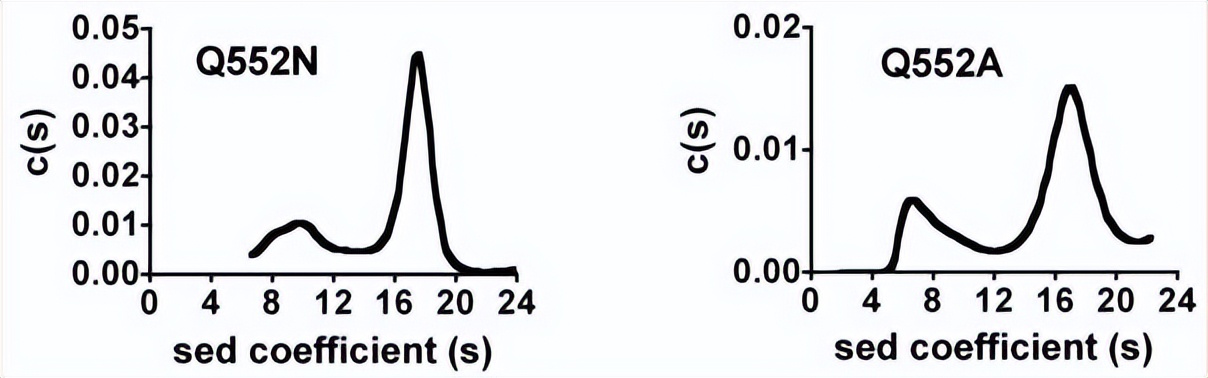
由于PC仅以四聚体形式具有活性,因此突变引起的结构扰动可能是导致RePC突变体失去丙酮酸羧化能力的原因,为了确定这些突变引起的活性缺失是否归因于催化或机理效应,而不是对酶的四级结构的影响,进行了超速离心沉降速度分析。
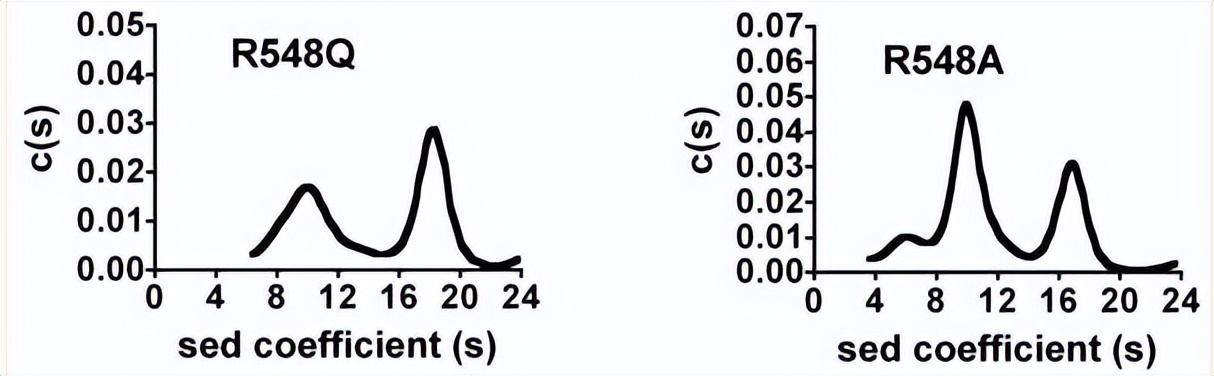
野生型RePC中存在的主要物种似乎具有沉降系数在15至19之间,相当于分子量为472±52 kDa的酶物种,对应于RePC四聚体的沉降系数,而R548K、Q552N和Q552A突变体产生多个峰,其沉降系数对应于单体、二聚体和四聚体RePC的分子量,主要以四聚体为主。
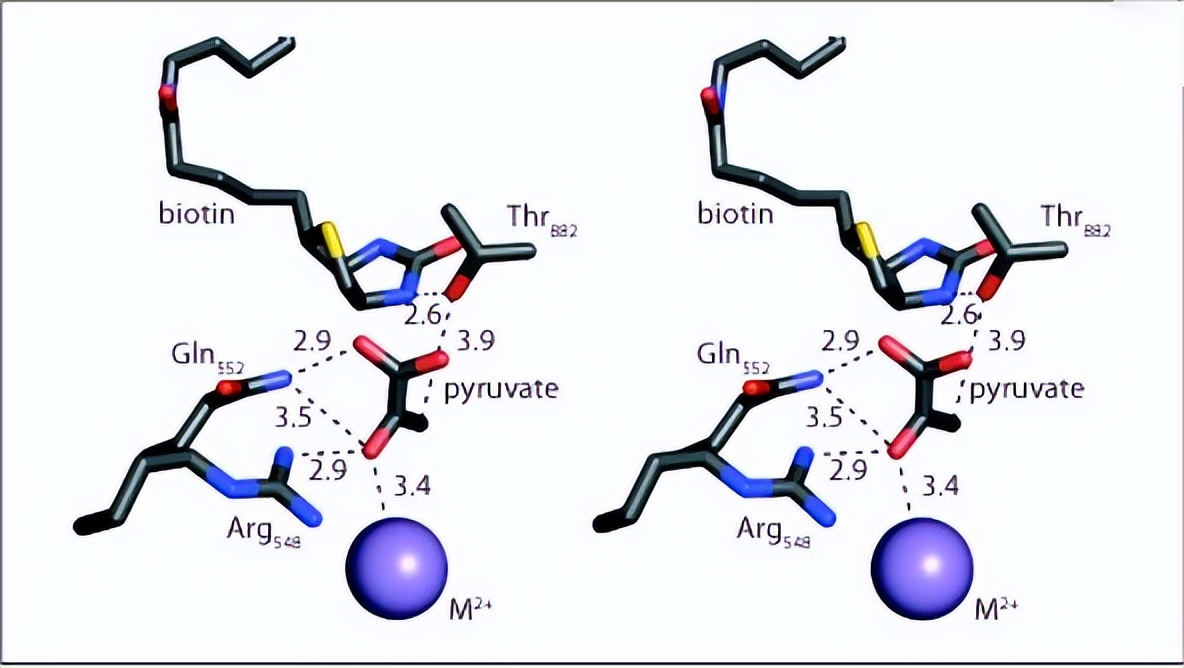
其中R548K、Q552N和Q552A突变体中四聚体物种的百分比分别为74%、76%和73%,与野生型RePC观察到的百分比相似,与其他突变体相比,R548Q和R548A突变体的四聚体RePC比例似乎要低得多,分别只占总酶物种的49%和34%,由于与野生型酶相比,这些突变体失去了大部分酶活性,这可以归因于四聚体酶结构的丧失,因此不再对R548Q和R548A突变体进行动力学分析。

为了研究突变对酶在催化反应中促进质子转移和丙酮酸烯醇化能力的影响,我们使用[3-2H3]丙酮酸作为底物,在含有90%的氘代水(2H2O)或非氘代丙酮酸的条件下进行实验。
在实验中,我们通过检测H NMR信号强度来计算每个时间点三种质子化形式(单质子、二质子和三质子化)丙酮酸的总浓度,从而确定酶催化的氘/质子交换程度以及2H2O和丙酮酸之间的交换情况。

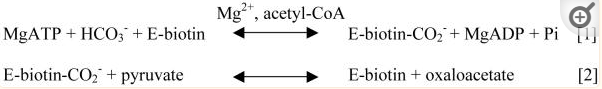
交换速率随时间呈线性变化,野生型RePC催化的交换速率常数为74 ± 3 min−1,在添加20mM草酸酯的情况下,该交换反应完全被抑制,由于已证明草酸结合在CT结构域的底物结合位点上,因此观察到在草酸存在下的质子交换反应的抑制表明这种交换反应发生在CT结构域的活性位点内。
四、结论
研究表明,Gln552和Arg548在CT结构域中发生的反应的催化机制中的拟议作用得到了这些残基的几种突变对整个反应和单个结构域的影响的支持。

虽然这些残基的单个突变导致大多数突变体RePC酶的丙酮酸羧化能力完全丧失,R98K突变体的活性损失为548%,但CT结构域突变体仍保留催化BC结构域的ATP切割和ADP磷酸化反应的能力。这些残基突变对CT结构域中发生的反应的直接影响在生物素依赖性草酰乙酸脱羧活性的丧失和催化丙酮酸和水之间质子交换的能力降低中是显而易见的。
相关文章:
飞盾保险柜全国维修服务号码04-03
万泰保险柜全国统一服务号码-全国服务热线04-03
博凡保险柜售后服务中心04-03
